Ⅰ. 서 론
무(Raphanus sativusLeaves)는 겨자과에 속하는 1년생 또는 월년생 초본으로 무의 수요가 급증할 때에는 무청이 대량 생산되는 시기임에도 불구하고, 소비율이 낮아 대부분의 무청은 사용하지 못한 채 폐기되는 실정이다(Kim et al., 2022). 그러나 무청을 건조한 우거지는 건물량 중 35% 이상이 식이섬유, 20% 내외의 단백질과 철분 및 칼슘 등을 함유한 양질의 식재료라고 알려져 있다(Ku et al., 2006). 무청(Raphanus sativusL.)은 건조하여 사용되며, 비타민 A와 C, 칼슘 함량이 뿌리부분에 비해 더 높을 뿐만 아니라, 식이섬유도 풍부하게 함유하고 있다(Seo et al., 2021).
메밀은 마디풀과(Poygonaceae)의 메밀속(Fagopyrum)에 속하는 일년초로 전 세계적으로 재배되고 있으나, 재배종으로는 흔히 알고 있는 일반메밀, 단메밀과 쓴메밀 혹은 타타리 메밀이라고도 불리는 흑메밀이 있다(Park et al., 2005). 쓴메밀(Fagopyrum tataricumGaertner)은 히말라야의 에베레스트 주변 고산지대 등에 주로 자식하며, 국내에서는 제주도가 전국 생산량의 40%에 달하는 최대 재배지이다(Ko et al., 2022b). 쓴메밀은 건강식으로도 많이 이용되며, 곡식용, 새싹채소, 엽채 등 다양한 형태로 소비되고 있다(Yoon et al., 2012). 쓴메밀은 영양이 풍부하고 단백질 함량(12%)과 지방 함량(3.9%)이 높으며, 10종 이상의 미네랄을 함유하고 있다(Park et al., 2007). 최근 고혈압 등과 같은 현대병에 시달리는 사람들에게 건강식의 하나로서 고함량의 rutin과 다양한 생리 활성으로 인해 주목받고 있다. 단메밀(Fagopyrum esculentumMoench)은 일반메밀이라고 불리며, 아시아의 전 지역을 비롯하여 유럽, 캐나다, 미국 등지에서 재배되고 있다(Chang et al., 2010).
여주(Momordica charanitiaL.)는 1년생 박과식물로 남미와 아시아의 아열대 및 열대 지역에서 재배되고 있다. 당뇨병 치료를 위해 사용되며, 약재로써 활용되고 있다(Senanayake et al., 2004). 비타민 C, 칼륨, 철분 등 미네랄이 풍부하며, 특히 혈당 저하 기능을 가지고 있는 charantin, momordicin 성분을 함유하고 있어, 기능성 성분이 높은 박과채소로 중요성이 높아지고 있다(Lee et al., 2012).
사람들의 식생활 습관이 변화함에 따라 당뇨, 비만, 고혈압, 심혈관 질환 등 다양한 질병에 대한 최근 인간의 수명이 증가하고, 건강에 대한 관심이 높아지면서 천연물 중심으로 다양한 기능성 소재를 개발하고, 이러한 소재들의 생리활성을 구명하기 위한 연구가 활발이 진행되고 있다(Yi et al., 2017). 그러나 다양한 소재의 추출 조건을 달리하여 최적 추출 공정 확립 및 제조된 추출물의 항산화, 항당뇨 활성을 비교한 연구는 미비한 실정이다.
본 연구는 제주산 무청, 쓴메밀, 단메밀, 여주를 대상으로 하여 각 천연물의 최적 주정 추출 시간을 선정하고자 하였다. 선정된 주정 추출 시간과 기존 연구에서 확립된 열수 추출 시간을 활용해 각 시료의 추출물을 제조한 후, 이들의 총 폴리페놀 함량, 항산화 활성, 항당뇨 활성을 비교 및 분석하였다. 이를 통해 최적의 추출방법을 도출하고, 항산화 및 항당뇨 효과가 뛰어난 메디바이오 소재를 발굴하여 기능성 식품 소재로서의 활용 가능성을 평가하고자 하였다.
Ⅱ. 재료 및 방법
실험에 사용된 무청과 여주는 각각 2023년 1월과 2022년 7월에 수확된 것을 유기농 나의 왼손(Jeju, Korea)으로부터 구매하였으며, 쓴메밀과 단메밀은 2023년 11월 수확된 것을 제주오라(Jeju, Korea)로부터 구매한 후 핀밀분쇄기를 이용하여 130 mesh의 사이즈로 분쇄하여 사용하였다. 무청은 일정한 크기로 절단하여 준비하였고, 여주는 분쇄 후 100 mesh 표준체로 1회 통과시킨 것을 시료로 사용하였다.
무청, 쓴메밀, 단메밀, 여주 추출물의 제조공정은 Fig. 1에 나타내었다. 주정 추출은 95% 발효주정을 70% 농도로 희석하여 70% 발효주정을 추출 용매로 사용하였으며 multi heating mantle(MS-EAM9203-06, Miseong Science, Seoul, Korea)을 이용한 환류 추출법(reflux extraction method)으로 추출을 진행하였다. 열수 추출은 사전 선행 연구에서 설정된 107℃, 0.15 MPa의 autoclave steam sterilizer(JSAC-40, JSR, Gongju, Korea)에서 모든 재료에 대하여 동일하게 8시간 동안 추출을 진행하였다. 이후 무청 추출물은 100 mesh의 표준체로 1차 여과 후 여과지(No. 4, Whatman filter paper, Maidstone, England)에 2차 여과를 진행하였으며, 여주, 쓴메밀, 단메밀 추출물은 원심분리기(LaboGene 1248R, LABOGENE, GYROZEN, Korea)로 원심분리 (3000 rpm, 25℃, 15 min)한 후 얻어진 상등액을 여과지(No. 4, Whatman filter paper, Maidstone, England)에 통과시켰다. 여과액은 회전 감압 증발 농축기(TYPE N-1300, EYELA, Tokyo, Japan)로 농축하였고, 이후 동결건조기(LP 20, IlShinBioBase, Maxwellstraat, Netherlands)를 이용하여 72시간 동안 건조하여 얻어진 분말을 최종 시료로 하여 분석에 사용하였다.
총 폴리페놀 함량은 Folin과 Denis(1912)의 방법을 일부 변형하여 측정하였다. 각 추출물의 동결건조 시료에 대하여 여러 농도별로 증류수와 함께 희석한 용액 100 µL에 Folin & Ciocalteu’s phenol reagent 50 µL, 35% Na2CO3 100 µL 넣고 증류수 750 µL 첨가하여 vortexing (Scientific Industries, Inc.)한 후, 상온의 암소에서 30분간 반응시켰다. 반응 후 96 well plate에 200 µL씩 분주하였고, microplate reader(Epoch™, BioTek Instruments Inc., Winooski, VT, USA)를 사용하여 760 nm에서 흡광도를 측정하였다. 측정하여 나온 흡광도 값을 이용하여 총 폴리페놀 함량을 나타내었다. 표준물질로는 gallic acid를 사용하였으며, 각 실험은 3회 반복 수행하여 평균값으로 나타내었다.
DPPH radical 소거능을 이용한 항산화력 측정은 Kim 등(2007)의 방법을 변형하여 측정하였다. 농도별로 희석한 시료 10 µL에 0.2 mM DPPH solution(2,2-diphenyl-1-picrylhydrazyl) 190 µL를 가한 후 혼합하였다. 암소에서 30분간 반응시킨 후 microplate reader를 이용하여 517 nm의 파장에서 흡광도를 측정하여 나온 흡광도 값을 아래 식에 대입하여 환산한 후 DPPH radical scavenging activity를 나타내었다. 각 실험은 3회 반복 수행하여 평균값으로 나타내었다.
Sample OD: Sample + Reagent
Blank OD: Sample + D.W
Control OD: D.W + Reagent
ABTS radical 소거능을 이용한 항산화력 측정은 Re 등(1999)의 방법을 변형하여 측정하였다. 7.4 mM ABTS[2,2’-azino-bis(3-ehtylbenzo-thiazoline-6-sulphonic acid)]와 2.6 mM potassium persulfate를 PBS(phosphate buffer saline(pH 7.4))용액에 용해하여 제조 후, 1:1로 혼합하여 혼합 시료를 제조한다. 혼합 시료를 실온의 암소에서 24시간 반응시켜 ABTS cation(ABTS+) radical을 형성한 후 732 nm에서 0.700±0.020의 흡광도가 되도록 PBS(pH 7.4)로 희석하여 사용하였다. 농도별로 희석한 시료 50 µL와 희석된 ABTS+ 용액 950 µL를 혼합하여 암소에서 10분간 반응시킨 후 microplate reader를 이용하여 732 nm의 파장에서 흡광도를 측정하여 나온 흡광도 값을 아래 식에 대입하여 환산한 후 ABTS radical scavenging activity를 나타내었다. 각 실험은 3회 반복 수행하여 평균값으로 나타내었다.
Sample OD: Sample + Reagent
Control OD: D.W + Reagent
FRAP 방법은 Fe3+이 Fe2+로 환원될 때의 변화를 측정하여 항산화 능력을 평가하는 방법으로 Benzie와 Strain(1996)의 방법을 이용하였다. FRAP reagent는 300 mM acetate buffer(pH 3.6)와 40 mM HCl에 용해한 10 mM 2,4,6-tris(2-pyridyl)-s-tri-azine(TPTZ), 20 mM FeCl3 · 6H2O를 10:1:1(v/v/v)의 비율로 혼합하여 제조하였다. 농도별로 희석한 시료 30 µL, 증류수 90 µL와 FRAP reagent 900 µL를 혼합하여 37℃에서 10분간 반응시킨 후 microplate reader를 사용하여 593 nm 파장에서 흡광도를 측정하였다. FRAP 활성 결과는 FeSO4 · 7H2O를 이용한 표준 검량곡선에 대입하여 환산 후 값을 구하였으며, 각 실험은 3회 반복 수행하여 평균값으로 나타내었다.
α-Glucosidase 저해 활성은 Lu 등(2022)의 방법을 일부 변형하여 측정하였으며, 측정방법은 다음과 같다. 각 농도별 시료액 25 µL와 0.2 U/mL α- glucosidase 25 µL를 혼합한 후 37℃에서 15분간 반응시키고, 3 mM ρ-nitrophenyl-α-D-glucopyranoside (ρ-NPG) 50 µL를 첨가하여 37℃에서 10분 동안 반응시켰다. 이 반응액에 0.2 mM Na2CO3 100 µL를 첨가하여 반응을 정지시킨 후 microplate reader를 이용하여 405 nm의 파장에서 흡광도를 측정하였다. α-Glucosidase 저해 활성은 흡광도 값을 아래 식에 대입하여 환산한 후 α- glucosidase inhibition activity를 나타내었다. 양성대조군으로는 α- glucosidase 저해제 및 치료제로 알려진 acarbose(Sigma-Aldrich Co.)를 사용하였으며, 각 실험은 3회 반복 수행하여 평균값으로 나타내었다.
Sample OD: Sample + Enzyme + Substrate + Na2CO3
Blank OD: Sample + Buffer + Na2CO3
Negative Control OD: Buffer + Enzyme + Substrate + Na2CO3
Ⅲ. 결과 및 고찰
페놀성 물질은 식물에 분포되어 있는 2차 대사산물로서 다양한 구조와 분자량을 가진다. 이들은 phenolic hydroxyl기를 가지기 때문에 단백질 및 기타 거대 분자들과 결합하는 성질을 가지며, 항산화 효과도 가진다(Kim et al., 2000).
제주산 무청, 쓴메밀, 단메밀, 여주 건물의 70% 주정 추출물과 열수 추출물의 총 폴리페놀 함량은 Fig. 2와 같다. 70% 주정 추출(Fig. 2A) 결과를 보면 12.5 mg/mL 농도에서는 무청(65.52 mg GAE/g)이 쓴메밀(58.86 mg GAE/g)보다 높은 총 폴리페놀 함량을 보였고, 6.25 mg/mL 농도에서는 쓴메밀(50.61 mg GAE/g)이 무청(45.64 mg GAE/g)보다 높은 값을 보였으나, 모두 유의적인 차이를 보이지는 않았다(p>0.05). 하지만 모든 농도에서 무청과 쓴메밀은 레몬, 단메밀보다 유의적으로 높은 총 폴리페놀 함량을 나타내었다(p<0.05). 그러므로 70% 주정을 이용한 무청과 쓴메밀 추출물은 비교적 높은 총 폴리페놀 함량을 가지는 것으로 생각된다.
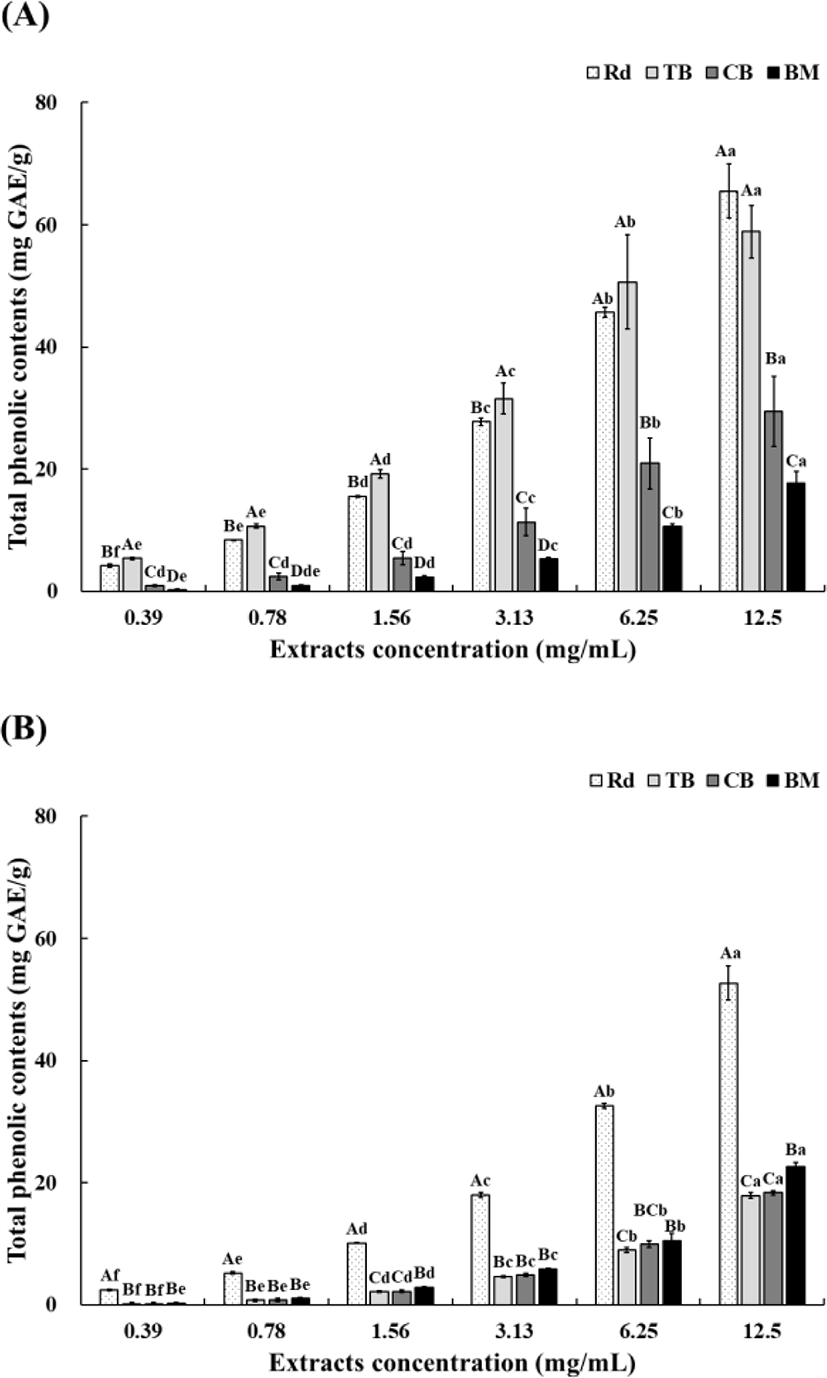
열수 추출(Fig. 2B) 결과를 보면 12.5 mg/mL 농도에서 무청은 52.67 mg GAE/g, 여주, 단메밀, 쓴메밀은 각각 22.59 mg GAE/g, 18.35 mg GAE/g, 17.92 mg GAE/g으로 무청과 나머지 3종의 시료의 총 폴리페놀 함량은 확연한 유의적인 차이를 확인할 수 있었다(p<0.05). 열수 추출물도 70% 주정 추출물과 마찬가지로 농도가 높아질수록 총 폴리페놀 함량이 증가하는 경향을 나타냈다. 70% 주정 추출물과 열수 추출물의 총 폴리페놀 함량이 가장 높게 나온 12.5 mg/mL 농도를 보면, 위에 제시한 결과를 토대로 무청, 쓴메밀, 단메밀은 70% 주정 추출물이 열수 추출물보다 총 폴리페놀 함량이 높게 나타남을 확인할 수 있었고, 여주는 70% 주정 추출물보다 열수 추출물에서 더 높은 함량을 보였다. Shin 등(2020)은 병풀 추출물의 총 폴리페놀 함량도 70% 주정 추출물이 열수 추출물보다 더 높은 것으로 보고되었다
Moon 등(2015)에서는 70℃ 추출조건에서 주정 농도가 증가할수록 총 폴리페놀 함량이 높게 측정되었다고 보고하였다. An 등(2020)은 식용버섯류의 추출 용매별 총 폴리페놀 함량을 비교하였을 때, 30% 발효주정보다 70% 발효주정이 더 높은 함량을 나타냈다고 보고하였다. 결과적으로 70℃ 추출조건에서 70% 주정으로 추출하였기에 최적의 조건에서 총 폴리페놀 함량을 측정한 것으로 판단하였다.
DPPH(2,2-diphenyl-1-picrylhydrazyl)는 분자 내에 free radical을 갖는 안정한 물질로서 free radical과 결합하여 안정된 complex를 만들고, 항산화 활성을 갖는 물질과 만나면 radical이 소거된다. 이때, DPPH 고유의 짙은 보라색을 잃고 노란색으로 변함에 따라 물질의 항산화 활성의 정도를 알 수 있다(Lee et al., 2012).
추출 용매에 따른 무청, 쓴메밀, 단메밀, 여주의 농도별 DPPH radical 소거 활성의 결과는 Fig. 3과 같다. 70% 주정 추출(Fig. 3A) 결과를 보면, 모든 농도에서 무청이 가장 높은 값을 나타내었다. 그 다음은 쓴메밀, 단메밀, 여주 순으로 높은 값을 보였다. 무청이 가장 높은 값을 보였으나, 12.5 mg/mL에서는 무청과 쓴메밀의 유의적 차이는 없었다(p>0.05). 여주를 제외한 나머지 3종 시료는 농도가 올라갈수록 활성이 낮아지는 경향을 보였으나 여주는 유의적 차이가 없었고(p>0.05), 무청과 쓴메밀은 유의적 차이가 있음을 확인하였다(p<0.05). 25 mg/mL와 50 mg/mL의 농도에서 무청은 74.13%와 69.32%, 쓴메밀은 66.92%와 61.41%로 유의적 차이가 있음을 확인하였으며(p<0.05), 다음으로 단메밀, 여주 순으로 높은 활성을 보였다. 특히, 무청과 쓴메밀의 농도가 25 mg/mL까지 증가하다가 50 mg/mL에서 유의적으로 감소함을 확인하였다(p<0.05).
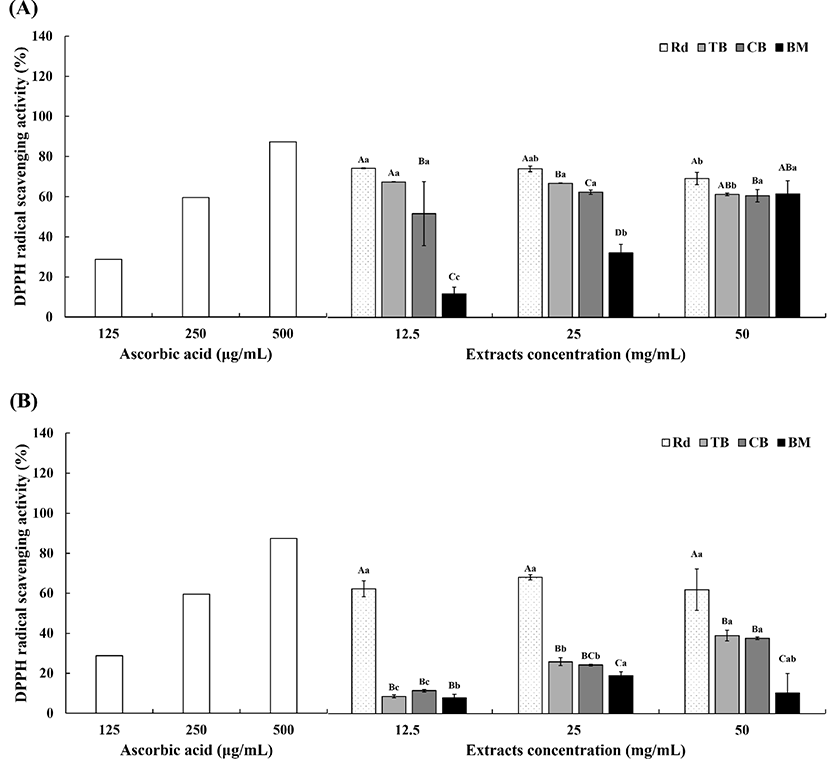
열수 추출(Fig. 3B) 결과를 보면 무청이 나머지 3종에 비하여 월등히 높은 값을 보여 유의적 차이가 있음을 확인하였으며(p<0.05), 나머지 3종에서는 유의적 차이가 무청에 비해 월등히 적거나 없었다. 무청은 25 mg/mL의 농도까지는 활성이 높아지다가 50 mg/mL에서 활성이 낮아지는 경향을 보였으나 유의적 차이는 없었다. 나머지 3종 시료인 쓴메밀, 단메밀, 여주는 활성이 농도 의존적으로 증가함을 확인할 수 있었다.
70% 주정 추출 결과와 열수 추출 결과, 무청과 쓴메밀은 25 mg/mL 농도 이상이 되면 충분한 항산화력이 있다고 판단하였다. 전체적인 결과를 보았을 때 70% 주정 추출(Fig. 3A)은 열수 추출(Fig. 3B)보다 DPPH radical의 소거 활성에서 높은 값을 나타냄을 확인할 수 있었다. 특히 추출 용매와 관계없이 무청의 DPPH radical 소거능이 가장 뛰어남에 따라 항산화 효과를 가진 천연물로써 이용 가능성이 높다고 판단되어진다. Han 등(2024)의 추출방법에 따른 명월초(Gynura procumbens)의 DPPH radical 소거 활성 측정 결과, 주정의 농도가 높을수록 활성이 높았으며, 동일한 추출물의 농도에서 주정 30% 추출물은 31.20%, 물 100% 추출물은 17.10%의 활성을 나타낸다고 보고하였다. 또한, Shin 등(2024)은 에탄올 비율이 증가할수록 치커리 뿌리의 DPPH radical 소거 활성이 증가한다고 보고하였다. 본 연구에서는 열추 추출 대비 70% 주정 추출하였을 때 높은 수치를 확인하였으나, 주정의 비율을 높여 추출하였을 때 활성에 어떤 변화가 있는지를 확인되지 않았기 때문에 추가적인 연구가 필요해 보인다.
ABTS [2,2'-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid)]를 이용한 항산화 활성 측정은 ABTS와 potassium persulfate와 반응하여 생기는 ABTS free radical (ABTS+)이 항산화 활성을 나타내는 물질과 반응하며 환원됨으로써 청록색에서 투명하게 탈색이 되는데 항산화 물질이 많을수록 투명하게 변하며, 탈색 정도가 클수록 시료의 항산화 활성이 높다는 것을 의미한다(Ko et al., 2022a).
추출 용매에 따른 무청, 쓴메밀, 단메밀, 여주의 농도별 ABTS radical 소거 활성의 결과는 Fig. 4와 같다. 4종 시료 모두 추출 용매와 관계없이 농도가 증가함에 따라 ABTS radical 소거 활성이 증가 경향을 보이거나, 증가하다가 비슷해지는 경향을 보였다.
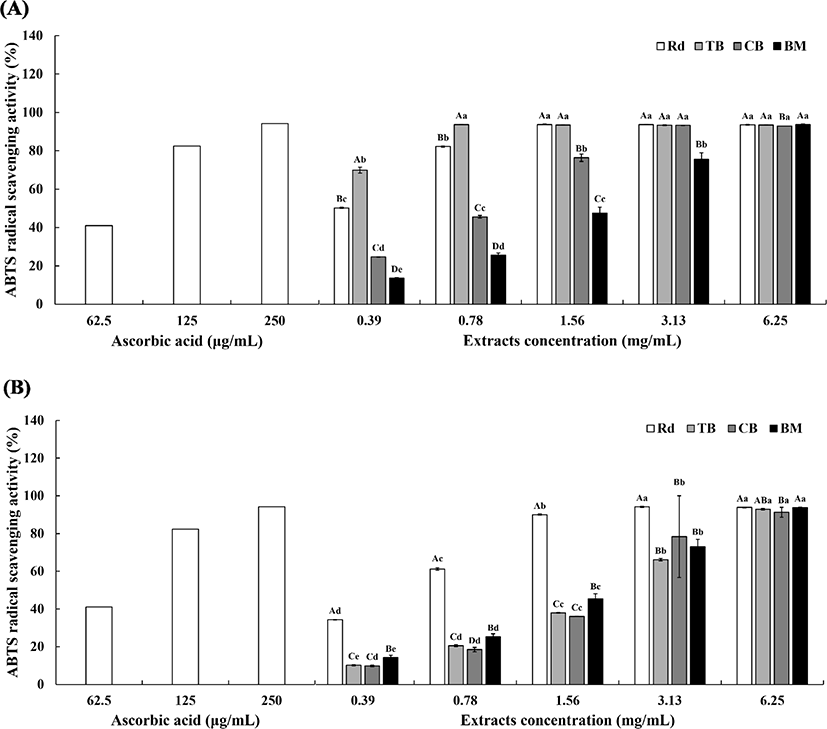
70% 주정 추출(Fig. 4A)에서 농도 0.39, 0.78 mg/mL에서 쓴메밀, 무청, 단메밀, 여주 순으로 높은 활성값을 가졌으며, 유의적 차이가 있음을 확인하였다(p<0.05). 3.13 mg/mL 이상의 농도에서는 여주를 제외하고 활성이 최대치에 가까워 유의적 차이가 없었다(p>0.05). 무청 70% 주정 추출물의 경우 0.39∼0.78 mg/mL의 농도에서는 추출물 농도가 증가함에 따라 ABTS radical 소거 활성이 유의적으로 증가하는 경향을 보였다가(p<0.05), 1.56 mg/mL의 농도부터는 활성이 93%대로 비슷한 수준을 보였다. 쓴메밀 70% 주정 추출물의 경우, 0.39 mg/mL의 농도에서 가장 낮은 ABTS radical 소거 활성(69.68%)을 나타내었고, 그 이상의 농도부터는 활성이 93%대로 무청과 비슷한 경향이 나타남을 확인할 수 있었다(Fig. 4A). 비교적 활성이 낮은 단메밀과 여주도 앞선 2종의 시료와 비슷한 양상을 보였다.
열수 추출 (Fig. 4B)에서는 4종 시료 모두 농도 의존적으로 활성이 증가하는 경향을 보였다(p<0.05). 시료 종류별로 보았을 때 무청, 여주, 쓴메밀, 단메밀 순으로 높은 활성값을 가졌으며, 쓴메밀과 단메밀에서는 유의적 차이가 없었다(p>0.05). 무청 열수 추출물의 경우, 낮은 농도에서도 나머지 3종 시료보다 유의적으로 월등히 높은 항산화 활성을 나타내었다(p<0.05). 무청 열수 추출물은 3.13 mg/mL에서 활성이 최대로 나타났으며, 쓴메밀, 단메밀, 여주 열수 추출물은 농도 의존적으로 증가하다가 6.25 mg/mL의 농도에서 활성이 최대로 나타났다.
추출법에 따라 비교해 보았을 때 70% 주정 추출 (Fig. 4A)은 열수 추출 (Fig. 4B)보다 ABTS radical의 소거 활성이 높은 수치를 나타낸다는 것을 확인하였다.
Kim(2018)과 Hwang(2019)의 연구결과에 의하면 브로콜리와 양배추의 주정 추출물이 열수 추출물보다 ABTS radical 소거 활성이 높게 측정되었다고 보고하였다. 또한, Shin 등(2024)의 연구결과에 따르면 추출용매의 에탄올 비율이 증가할수록 라디칼 소거 활성이 증가한다고 보고하였다. 주정은 물과 다르게 유기용매이므로 추출 시 유기용매의 비율이 증가할 때 항산화 효과가 증가하는 이유로는 시료 내의 폴리페놀류 화합물이 유기용매와 반응하기에 적합한 hydroxyl group이 포함되어 있는 입체적 구조의 화합물이기 때문일 것이라고 판단하였다(Lee et al., 2015). 이러한 연구결과를 바탕으로 열수 추출 대비 주정 추출을 했을 때 생리활성 성분이 효과적으로 추출되어 라디칼 소거 활성이 높게 측정되었을 것이라 판단하였다.
FRAP 활성은 항산화 물질에 의해 ferric tripyridyltriazine(Fe3+-TPTZ)가 ferric tripyridyltriazine(Fe2+-TPTZ)으로 환원되는 원리를 이용하여 확인한다. 항산화 물질이 많을수록 파란색을 띤다(Kim et al., 2012). 추출 용매에 따른 무청, 쓴메밀, 단메밀, 여주의 농도별 FRAP 결과는 Fig. 5와 같다.
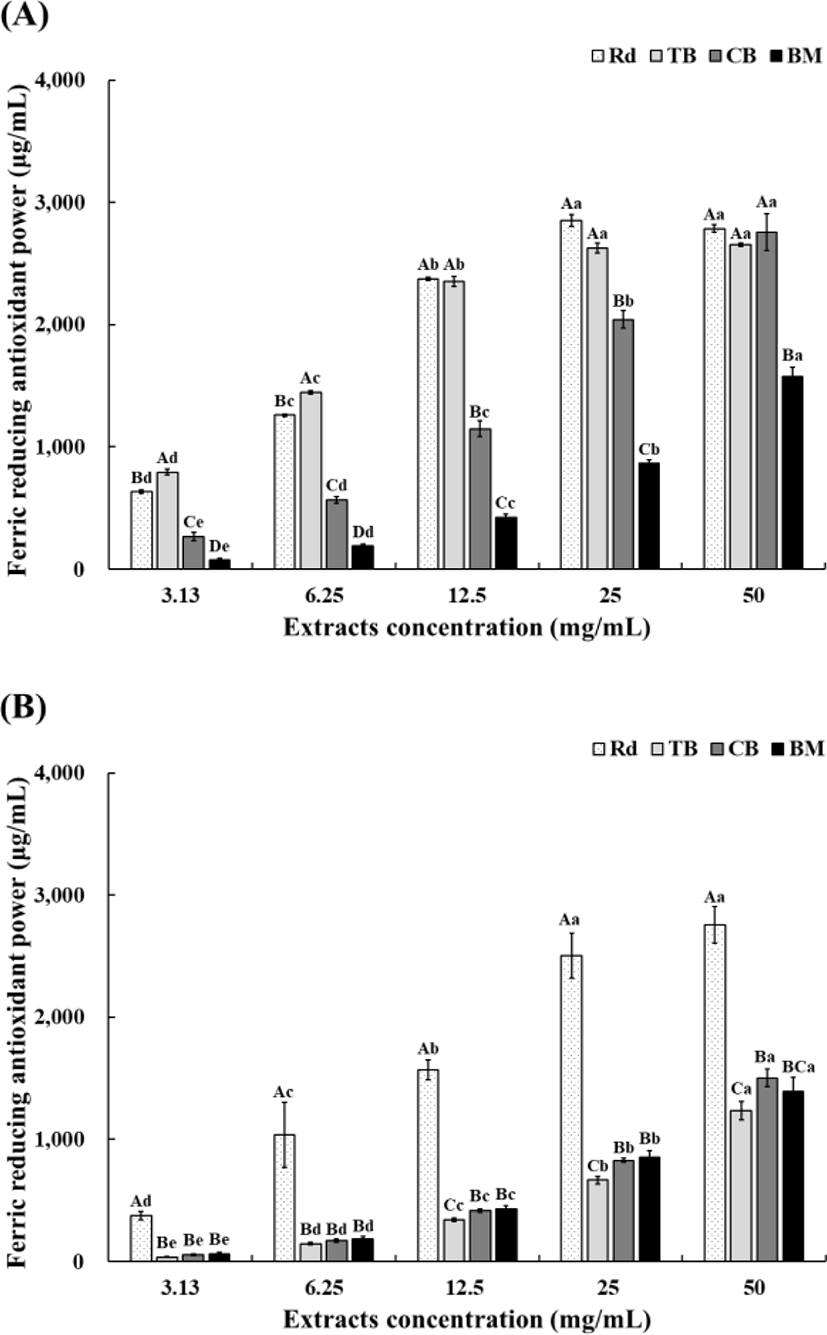
70% 주정 추출(Fig. 5A)의 경우, 무청, 쓴메밀, 단메밀, 여주 순으로 높은 활성 값을 보였다. 무청 70% 주정 추출물의 경우, 25 mg/mL 농도에서 2,851.09 FeSO4 · H2O µg/mL로 가장 높게 측정되었다. 50 mg/mL 농도에서 2,784.56 FeSO4 · H2O µg/mL로 25 mg/mL 농도보다 FRAP 값이 감소함을 보였지만, 연구에 사용된 시료 4종 중 같은 농도에서 가장 높은 항산화 활성을 나타내었다. 25 mg/mL부터 농도에 따른 시료의 유의적 차이가 없음을 확인하였다(p>0.05). 이는 25 mg/mL 농도 이상이 되면 충분한 항산화 효과가 나타나는 것으로 판단하였다. 쓴메밀 70% 주정 추출물의 경우, 50 mg/mL에서 2,762.05 FeSO4 · H2O µg/mL로 가장 높게 측정되었다. 시료의 농도가 증가할수록 FRAP 값이 증가함을 확인하였으나, 25 mg/mL 이상의 농도에서는 유의적 차이를 보이지 않았다(p>0.05). Kim 등(2009)은 쓴메밀의 70% 주정 추출물은 열수 추출물에 비해 항산화 활성이 뛰어남을 보고한 바 있다. 이외에도, 쓴메밀의 효소 처리로 수용성 고형분 함량이 증가하며, 항산화 활성이 증가하는 것으로 나타났다. 단메밀 70% 주정 추출물의 경우, 추출물의 농도가 증가함에 따라 FRAP 값은 유의적으로 증가하는 경향을 보였다(p<0.05). 농도 50 mg/mL에서 2,754.10 FeSO4 · H2O µg/mL로 가장 높은 활성을 보였다. 여주 70% 주정 추출물의 경우, 농도가 증가함에 따라 FRAP 값은 유의적으로 증가하는(p<0.05) 경향을 보였으며, 50 mg/mL에서 1,573.24 FeSO4 · H2O µg/mL로 높은 FRAP 값을 가졌다. 하지만 여주 70% 주정 추출물의 경우, 다른 시료들에 비해 약 2배 낮은 FRAP 값을 가지는 것을 확인할 수 있었다.
열수 추출물(Fig. 5A)의 경우, 무청, 단메밀, 여주, 쓴메밀 순으로 높은 활성값을 가졌다. 무청 열수 추출물의 경우, 50 mg/mL에서 2,756.13 FeSO4 · H2O µg/mL로 가장 높은 값을 나타내었다. 25 mg/mL부터 농도에 따른 시료의 유의적 차이가 없음을 확인하였다(p>0.05). 이는 위와 같이, 25 mg/mL 농도 이상이 되면 충분한 항산화 효과가 나타나기 때문으로 생각된다. 쓴메밀 열수 추출물의 경우, 저농도(1.56 mg/mL)에서는 FRAP 값이 나타나지 않았다. 3.13 mg/mL부터 추출물의 농도가 증가할수록 FRAP 값은 유의적으로 증가하는 경향을 보였다(p<0.05). 쓴메밀 열수 추출물의 경우, 50 mg/mL에서 1,235.74 FeSO4 · H2O µg/mL로, 유의적으로 가장 높게 측정되었다(p<0.05). 단메밀 열수 추출물의 경우, 농도가 증가함에 따라 FRAP 값이 증가함을 확인하였다. 농도 50 mg/mL에서 1,502.38 FeSO4 · H2O µg/mL로 가장 높은 활성을 보였다. 여주 열수 추출물의 경우, 농도가 증가함에 따라 FRAP 값은 유의적으로 증가하는(p<0.05) 경향을 보였으며, 50 mg/mL에서 1,390.90 FeSO4 · H2O µg/mL의 FRAP 값을 나타냈다.
추출용매에 따른 무청, 쓴메밀, 단메밀, 여주 4종 시료의 항산화 활성에 대한 연구결과, 모든 농도에서 70% 주정 추출(Fig. 5A)이 열수 추출(Fig. 5B)보다 높은 철 이온 환원력을 가지는 것을 확인하였으며, 이는 열수 추출에 비해 70% 주정 추출물에서 생리활성 물질의 추출 효과가 비교적 높다고 판단하였다.
Kang 등(2018)과 Lee 등(2016)의 보고에 따르면 여주의 항산화 활성은 함유되어 있던 식물추출물 중의 페놀화합물에 기인한 결과로 판단하였다. Kang 등(2018)은 국내산 여주의 항산화력을 측정한 결과, 항산화 활성을 측정한 모든 농도에서 물과 50% 에탄올 추출물 간 유의적인 차이는 확인할 수 없었다(p>0.05). 따라서 여주는 추출용매에 따른 항산화력의 차이가 없음을 알 수 있었다.
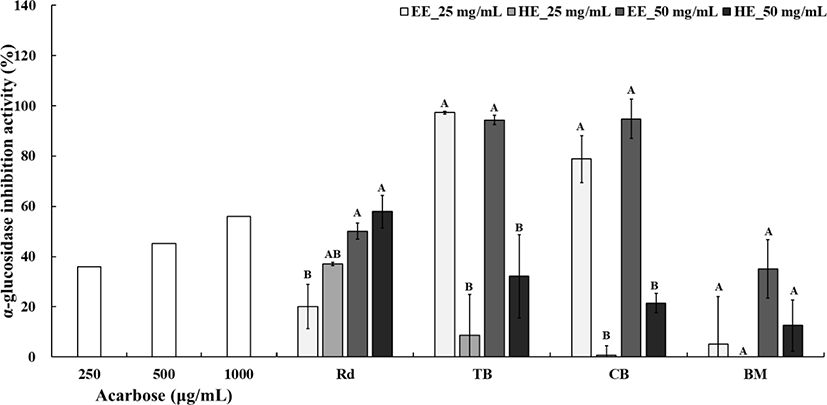
α-Glucosidase는 소장 상피세포에 존재하는 효소로, 탄수화물을 단당류로 분해하여 소장에서 흡수되도록 하는 역할을 한다(Lee et al., 2016). α-Glucosidase 저해제는 소장 점막의 미세융모막에 위치한 이당류 분해효소의 작용을 가역적으로 억제하여 탄수화물의 흡수를 지연시키는 효과가 있다(Kim et al., 2011). 그러나 시판 중인 α-Glucosidase 저해제는 장기 복용 시 부작용이 발생할 수 있어 사용에 제한이 있다(Kim et al., 2013). 이에 본 연구는 이러한 부작용을 최소화할 수 있는 생리활성 성분을 가진 천연 기능성 식품 소재의 개발을 목표로 하였으며, 제주산 4종 작물의 추출방법에 따른 α-Glucosidase 저해 활성을 평가하여 혈당 상승 억제제로서의 가능성을 검토하고자 하였다.
25 mg/mL와 50 mg/mL 농도의 α-Glucosidase 저해 활성 실험에서 양성대조군으로 acarbose를 사용하여 추출방법에 따른 저해 활성을 비교한 결과, 여주 추출물은 농도와 추출 방법에 따른 유의미한 차이를 보이지 않았고, 무청 추출물 또한 25 mg/mL 농도를 제외하고는 유의적인 차이가 없었다(p>0.05). 그러나 무청은 50 mg/mL 농도에서 열수 추출(HE) 결과, 60.12%의 저해 활성을 보여 다른 시료보다 유의하게 높은 활성을 나타냈다(p<0.05). 쓴메밀과 단메밀의 경우 70% 주정(EE) 추출물에서 유의미하게 높은 α-Glucosidase 저해 활성을 보였으나, 농도에 따른 차이는 없었다(p>0.05).
선행 연구에 따르면, 쓴메밀 추출물은 70% 에탄올과 메탄올 추출 시 α-Glucosidase 저해 활성이 농도 의존적으로 증가하였으나, 물 추출물에서는 저해 활성이 관찰되지 않았다고 보고된 바 있다(Kim et al., 2009). 특히, 쓴메밀의 70% 에탄올 및 메탄올 추출물의 저해 활성은 rutin과 quercetin과 같은 플라보노이드 성분이 기여하는 것으로 추측된다. Lee 등(2006)은 quercetin이 α-Glucosidase에 비경쟁적으로 결합하여 천천히 저해하는 작용을 하여 당뇨병 치료에 잠재성을 가질 수 있다고 보고하였다. 본 연구에서도 쓴메밀과 단메밀이 70% 주정 추출에서 높은 α- glucosidase 저해 활성을 보여 항당뇨 기능성 소재로의 활용 가능성을 확인하였다.
Ⅳ. 요 약
본 연구에서는 제주산 무청, 쓴메밀, 단메밀, 여주에서 주정(70%) 및 열수 추출을 통해 얻은 추출물을 농축 후 동결 건조하여 분말화하였고, 이를 증류수로 희석하여 다양한 농도로 총 폴리페놀 함량, 항산화 및 항당뇨 활성을 측정하였다. In vitro 실험 결과, 전반적으로 70% 주정 추출물이 열수 추출물보다 높은 활성을 보였다. 특히, 총 폴리페놀 함량, DPPH 및 ABTS 라디칼 소거능, FRAP 활성에서 무청이 가장 높은 활성을 나타냈고, 쓴메밀도 유의미한 수준(p<0.05)에서 비슷한 활성을 보였으며, 단메밀과 여주는 상대적으로 낮은 활성을 보였다. α-Glucosidase 저해 활성 측정 결과, 메밀 추출물이 다른 시료보다 현저히 높은 활성을 나타냈다. 본 연구를 통해 70% 주정 추출이 건조된 제주산 작물의 항산화 및 항당뇨 성분을 효과적으로 추출할 수 있음을 확인하였으며, 이를 통해 건강 기능성 식품 소재로 활용할 가치가 있다고 판단된다. 또한, 주정은 추출 과정에서 회수하여 재사용할 수 있어 효율적이고 친환경적인 공정이 가능함을 보여주었다. 본 연구 결과는 제주산 작물을 활용한 기능성 식품 소재 개발의 기초 자료로 활용될 수 있을 것이다.






