Ⅰ. 서 론
전 세계적으로 동물성 단백질에 대한 수요는 2005년부터 2050년까지 약 76%가 증가할 것이라고 예상된다(Alexandratos and Bruinsma, 2012). 동물성 단백질인 식육은 필수 아미노산이 균형 있게 포함되어 있어 인간 식단에서 중요한 단백질 공급원이 될 수 있다(Jeon et al., 2024). 그러나 지구의 자원인 토지와 물의 제한성과 온실가스와 같은 환경문제로 인해 가축 사육만으로는 미래의 식육 수요를 완전히 충족시키는 데 한계가 있을 것으로 보인다(Alexander et al., 2017). 더불어 인구가 증가하는 만큼 식육 단백질에 대한 수요가 지속적으로 증가할 것으로 예상되지만, 이에 상응하는 육류 단백질 공급은 점차 어려워지고 있어 식량 안보 문제가 부각될 것으로 전망된다(Kim et al., 2021). 이에 따라, 미래의 지속 가능한 단백질 공급원을 확보하기 위해 식육을 대체할 자원이 필요하다고 판단되고 있으며, 이에 국제연합식량농업기구(FAO)는 대안 중 하나로 식용 곤충을 제안하고 있다(Nam, 2019).
식용 곤충은 전체 구성성분 중 단백질을 50% 이상 다량 함유하고 있을 뿐만 아니라, 필수아미노산 조성도 우수한 양질의 단백질 자원으로서 영양적 가치가 높다고 평가되고 있다(Kim et al., 2024). 또한 불포화지방산 함량이 높으며, 구리, 마그네슘, 아연과 같은 미량 무기질도 풍부함으로 영양가 높은 단백질을 제공하는 공급원이 될 수 있다(Rumpold and Schlüter, 2013). 더욱 나아가 최근 연구에서는 식용 곤충 단백질의 높은 소화율을 연구한 사례가 있었으며, 식용 곤충의 항산화 효과 등 식용 곤충 성분의 기능적 특성에 관한 사실도 밝혀낸 바 있다(Huang et al., 2019). 식용 곤충과 같은 경우 육류와 비교했을 때 식용 단백질 1 g을 생산하는 데 약 8-14배 정도 적은 토지를 필요로 하며, 온실가스 배출량도 육류와 비교하여 약 6-13배 낮아서 환경에 미치는 영향이 적다(Van Huis and Oonincx, 2017). 영양 및 환경적 차원에서 이러한 장점들로 인하여 식용 곤충을 육가공품에 첨가하여 일부 식육 단백질을 대체하거나, 식용 곤충만을 이용한 육가공품을 개발하고자 하는 노력과 연구들이 진행 중이다(Choi et al., 2024; Choi et al., 2017; Yong et al., 2023).
현재, 80여 개의 국가에서 약 1,900종 이상의 식용 곤충이 소비되고 있다(Yong et al., 2023). 그 중 대표적인 종인 갈색거저리(Tenebrio molitor)는 전 세계적으로 분포하며, 사육이 비교적 쉬워서 대규모 생산에 적합한 식용 곤충으로 알려져 있다(Mancini et al., 2019). 갈색거저리 유충 분말을 함유한 소시지의 맛과 연도 부분에서 관능적 품질이 우수하다는 연구 결과도 있다(Choi et al., 2017). 하지만 갈색거저리에 대해 오염 미생물을 분석한 결과, 7 log CFU/g 정도 높은 수준의 일반 세균 오염을 보였으며, 토양미생물인 Bacillus sp., Clostridium sp. 등도 검출되었다(Stoops et al., 2016). 육가공품에서 미생물학적 안정성은 식품의 영양적 특성과 기능적인 특성보다 더 중요하게 여겨져야 한다. 식용 곤충을 이용한 육가공품의 개발에 노력이 이루어지고 있지만, 미생물 안정성에 관한 연구는 아직 부족한 실정이다. 따라서 식용 곤충을 첨가한 패티와 같은 육가공품의 미생물학적 안정성을 확보하기 위한 관리 방안이 필요하다.
예측 미생물학(predictive food microbiology, PFM)은 식품이 위생적으로 생산 및 유통될 수 있도록 관리 방안을 마련하기 위해, 식품 내 존재하는 미생물의 성장 및 사멸 과정을 특정 매개변수들을 활용한 수학적 모델을 통해 정량적으로 분석하고 예측하는 연구이다(McMeekin et al., 2008). 이는 식품이 지니고 있는 고유의 내적 요인(첨가물의 양, 수분 활성도, pH 등) 또는 외적 요인(저장 온도, 습도 등)이 미생물의 생장과 사멸에 미치는 영향을 기반으로 계산한다(Yoon, 2010). 미생물 예측 모델은 1차 모델과 2차 모델로 나눌 수 있다. 1차 모델은 다양한 내적 요인 또는 외적 요인 조건의 식품에서 시간 경과에 따른 미생물의 생장과 사멸 예측에 사용된다. 이를 이용하여 미생물의 유도기, 초기 세균 수, 최대 생장 세균 수, 최대 생장률을 계산할 수 있다. 2차 모델은 1차 모델에서 개발된 변수들(유도기, 생장률 등)이 다양한 환경 조건에 의하여 어떻게 변화하는지를 예측하는 모델이다(Lee and Yoon, 2016). 정확한 모델링을 위해서는 모델링에 적합한 실험을 계획하고, 미생물 실험결과를 바탕으로 적합한 수학적 모델을 선택해야 한다(Yoon, 2010). 특히 1차 모델 설정하는 단계는 매우 중요하며, Baranyi model, modified Gompertz model, logistic model 등의 다양한 수학적 모델을 적용, 비교, 검증하여 그 정확성을 평가할 필요성이 있다(Baranyi et al., 1999).
많은 육가공품들이 예측미생물학을 통해 생산 공정에 있어서의 미생물 수 변화를 추정하고, 위해요소(hazard analysis) 및 중요 관리 지점(critical control point)을 결정하고자 한다(Fakruddin et al., 2012). 이는 육가공품 생산 시 미생물학적 안전관리 기준 설정 및 관리 방안 등 미생물 기준규격을 설정하는 데 활용될 수 있다(Yoon, 2010). Heo et al. (2008)과 Heo et al. (2009)은 미강 식이섬유 첨가 수준에 따른 떡갈비와 소시지의 미생물 성장 예측 1차 모델을 선정하는 연구를 진행한 바 있다. 하지만 현재로선 식용 곤충이 첨가된 육가공품의 예측 미생물학을 적용하여 미생물 예측 모델을 개발한 연구는 부족한 실정이다. 따라서 본 연구에서는 다양한 수준(0, 4, 8%)의 갈색거저리 유충 분말로 대체된 햄버거 패티의 미생물학적 안전성을 확인하기 위하여 저장기간에 따른 총 호기성 세균, 대장균 수를 측정하였다. 이후 총 호기성 세균에 Baranyi model과 modified Gompertz model을 적용하여 미생물 예측모델을 개발하고 비교 및 검증하고자 한다.
II. 재료 및 방법
본 실험에 사용된 갈색거저리 유충 분말은 풍이푸드(Gyenggido, Korea)에서 분말 형태로 구입하였다. 돈육 후지는 대전광역시 유성구에 위치한 정육점에서 도축 후 48시간 이내의 국내산 냉장 분쇄육으로 구매하였으며, 원료육과 등지방은 각각 8 mm 플레이트(PM-100, Mainca, Germany)로 분쇄된 형태로 실험에 사용되었다. 분쇄 돈육과 등지방은 구매 당일 실험에 사용하였으며, 구매한 갈색거저리유충 분말 또한 개봉 직후 실험에 사용하여 신선도를 유지하고 잠재적인 오염을 방지하였다. 햄버거 패티 제조를 위하여 분쇄 돈육은 소금, 설탕, 아스코르브산, 양파 분말, 마늘 분말 등과 함께 지방 및 빙수를 첨가하여 Table 1의 배합비에 따라 4°C에서 15분간 혼합하였다. 혼합된 반죽(20 g)은 지름 약 8 cm의 햄버거 패티 성형기로 압착하여 성형하였다. 실험을 위하여 패티는 갈색거저리 유충 분말이 첨가되지 않은 대조군(Control, T. molitor powder 0%)과 갈색거저리 유충 분말을 각각 4%, 8%을 첨가한 처리군(T. molitor powder 4%, 8%)으로 나누어 제조되었다. 제조한 패티는 각각 함기 포장(polyethylene bags, 2020 cm2)하였으며, 냉장 온도(4±1°C)에서 20일간 저장하였다.
냉장 저장 중 햄버거 패티의 총 호기성 미생물과 대장균수는 식품공전을 바탕으로 측정하였다. 패티 20 g을 0.85% 멸균생리식염수 180 mL가 담긴 멸균 샘플백(3M, USA)에 넣어 10배 희석한 후 stomacher(BagMixer® 400, Interscience, France)를 이용하여 2분 동안 균질화 하였다. 균질화된 시료는 0.85% 멸균생리식염수를 이용하여 십진 희석을 진행하였으며, 희석된 시료(0.1 mL)는 총 호기성 미생물 수와 대장균 수를 확인하기 위하여 각각 plate count agar (PCA, Difco, USA)와 eosine methylene blue agar (EMB, Difco, USA)에 도말하였다. 모든 배지는 36±1°C로서 24시간 동안 배양하였으며, 배양 후 배지 위에 형성된 균체(colony)를 계수하여 colony forming unit(CFU)/g으로 나타내었다.
균 수의 S자 모양 형태의 성장을 표현하기 위해서 사용된 함수의 식은 Baranyi and Roberts (1994)가 제시한 Baranyi function을 사용하였다. 일반 미생물의 저장 기간에 따른 정량적 분석을 기준으로 Baranyi 함수에 대입하여 수학적 모델을 도출하였다. DMFit(3.5 version)을 사용하여 수학적 모델의 매개변수인 최대성장률(maximum growth rate, µmax), 유도기(lag phase duration, LPD)를 구하였다. Baranyi model 수식은 아래와 같다.
N(t): 시간 t에서의 미생물 값(log CFU/g)
y0: 초기 미생물의 값(log CFU/g)
ymax: 최대 미생물 값(log CFU/g)
µmax: 최대 성장률(log CFU/g/h)
위 수식에서 h0값은 미생물의 초기 유도기(LPD) 동안의 잠재적 성장 억제 효과를 의미한다. 즉 h0는 성장 억제 요인이 존재하는 상태에서 미생물이 적응하는 정도를 나타내는 것이고, µmax와 LPD의 곱으로도 나타낼 수 있다. 모든 결과는 log CFU/g으로 표시하였다.
Modified Gompertz model은 저장 기간에 따라 미생물 성장 패턴을 예측하는 데 사용되는 수학적 모델이며, 초기 값과 최대 값 사이의 성장을 곡선 형태로 나타낼 수 있다. Modified Gompertz model 수식은 다음과 같다.
Y(t): 시간 t에서의 미생물 값(log CFU/g)
y0: 초기 미생물 값(log CFU/g)
ymax: 최대 미생물 값(log CFU/g)
µmax: 최대 성장률(log CFU/g/h)
γ: 유도기(LPD)
Modified Gompertz model의 각 매개변수들은 GraphPad Prism software(GraphPad Software Inc., USA)을 사용하여 도출되었으며, 매개변수들을 모델에 대입함을 통하여 미생물 예측 모델을 얻었다.
Baranyi model과 modified Gompertz model, 두가지 모델의 성장예측곡선 적합성 평가를 위해 R2, 평균 제곱근 오차(root mean square error, RMSE), bias factors(Bf), accuracy factors(Af) 값들을 비교하였다. 각 값들은 다음과 같은 식을 통해 계산된다:
위 수식에서 obs는 관측 값, pred는 예측 값, n은 관측 값의 숫자를 나타낸다. Baranyi model과 Modified Gompertz model 각각의 값을 측정하여 식용 곤충을 첨가한 패티의 총 호기성 미생물 예측곡선은 어떤 모델을 사용하는 것이 적절한지 판단하였다. RMSE값은 수학적 모델의 성능을 평가할 때 이용하며, 모델의 예측 값과 실제 값 사이의 오차 크기를 측정한다. Bias factors는 예측 값과 실제로 측정한 값의 상대적 편차의 측정이며, Accuracy factors는 예측치가 얼마만큼 실측치와 차이나는지를 측정한 값을 의미한다.
III. 결과 및 고찰
T. molitor powder를 이용하여 일부 돈육을 대체한 햄버거 패티를 냉장 조건에서 20일간 저장했을 때의 총 호기성 세균 수를 Table 2에 나타냈다. 저장 0일차에 T. molitor powder로 각각 0(control), 4%, 8% 대체한 햄버거 패티의 총 호기성 세균 수는 각각 3.71, 3.76, 3.75 log CFU/g으로 나타났다. 모든 햄버거 패티 처리군의 총 호기성 세균은 저장 3일차까지 증가하지 않았으나(p>0.05), 저장 7일차부터는 유의적으로 증가하여 약 5 log CFU/g 수준으로 나타났으며(p<0.05), 저장 20일차에는 약 6 log CFU/g 수준까지 유의적으로 증가하였다(p<0.05). T. molitor powder의 대체 수준에 따른 총 호기성 세균 수는 저장 0일차에서 18일차까지 모두 유의적인 차이가 없었다(p>0.05). 하지만, 저장 20일 차에서 T. molitor powder로 4%, 8% 대체한 패티의 총 호기성 세균 수는 각각 6.26, 6.29 log CFU/g으로 T. molitor powder로 대체하지 않은 패티(6.11 log CFU/g)보다 유의적으로 높게 나타났다(p<0.05).
대장균은 일반적으로 식용 곤충에서 흔히 관찰되는 위생 지표 미생물이다(Grabowski and Klein, 2017). 때문에 본 연구에서 T. molitor powder로 대체(0, 4, 8%)한 햄버거 패티의 모든 저장기간동안 대장균을 확인해 보았으나, 모두 검출 한계(<1 log CFU/g)이하의 수준을 보였다(Data not shown).
일반적으로 식용 곤충은 토양 및 환경미생물에 오염이 되어 높은 미생물 수를 나타낸다고 보고된다(Stoops et al., 2016). 하지만 본 실험에 이용된 T. molitor powder의 총 호기성 세균과 대장균은 검출 한계(<1 log CFU/g)이하로 나타났다(Data not shown). 이러한 이유로 저장 0일부터 18일차까지 T. molitor powder 대체 수준에 따른 햄버거 패티의 총 호기성 세균 수에는 유의적인 차이가 없었던 것으로 판단된다. 한편, 저장 20일차에서 T. molitor powder로 4%, 8% 대체한 패티의 총 호기성 세균 수가 대조군(control)보다 유의적으로 높았던 구체적인 이유에 대해서는 추가적인 연구를 통해 확인하고 구명할 필요성이 있다. 다만, Pettersson과 Bååth(2003)에 따르면 일부 토양미생물은 주변 영양조건이나 pH조건과 같이 내재된 환경 변화에 적응하고 성장하기까지 일정한 시간이 필요하다고 보고한 바 있다. 본 연구에 이용된 T. molitor powder가 무균 제품이 아니기에 검출 한계(<1 log CFU/g)이하로 존재하던 일부 환경 미생물들이 장기간의 저장시간동안 주변환경에 적응하며 증식했을 가능성이 있는 것으로 추정된다.
El Wahab 등(2019)은 제조한 소고기 패티를 랩 포장하여 냉장 보관하였을 때, 총 호기성 세균수가 저장 21일차에서 5.40 log CFU/g, 24일차에서 6.40 log CFU/g의 값을 나타냈다. 염소고기 패티를 제조하여 함기포장으로 냉장 보관하였을 때, 저장 20일과 25일차의 총 호기성 세균 수는 각각 4.54 및 5.08 log CFU/g을 보였다(Rajkumar et al. 2004). Kumar 등(2015)이 돼지고기 패티를 함기포장으로 21일간 냉장 보관하였을 때 총 호기성 세균 수는 5.13 log CFU/g 였으며, Park과 Chin(2014)이 제조한 돼지고기 패티는 함기포장으로 21일간 저장했을 때 7 log CFU/g 이상으로 나타났다. 한편, 본 연구에서 제조한 햄버거 패티는 20일간 함기 포장 및 냉장 저장하였을 때 6 log CFU/g 수준으로 나타났다. 햄버거 패티는 제조 과정에서 다양한 재료가 첨가되며, 이들 각각의 상태가 상이하기 때문에 제조 환경 및 조건에 따라 미생물 수의 수준이 다르게 나타나는 것으로 추정된다.
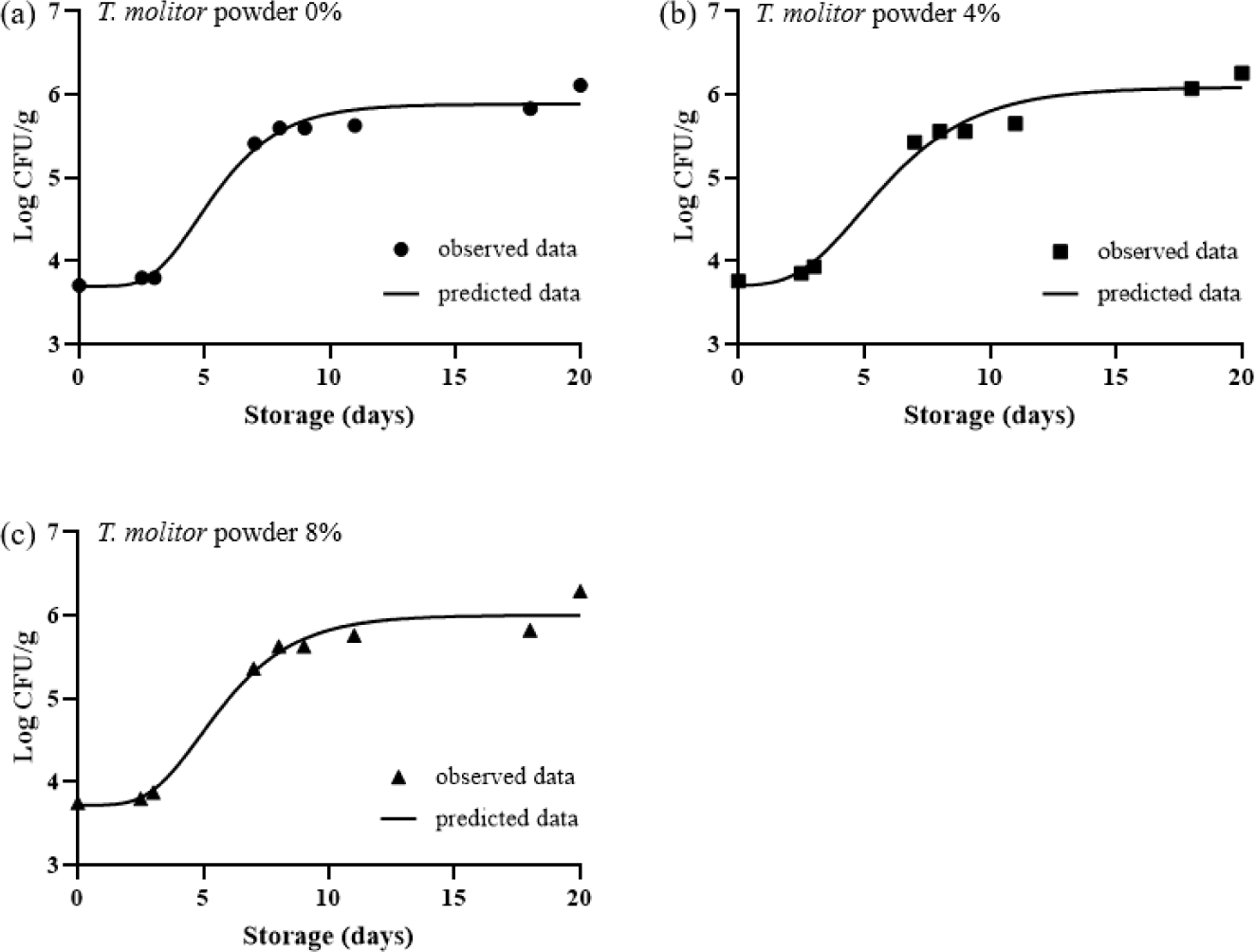
미생물 성장을 예측하는 1차 모델로는 Baranyi model, Gompertz model 등 다양한 함수들이 존재한다(Pal et al., 2008). 그 중 Baranyi model은 예측미생물학 분야에서 많은 연구가 진행되어져 왔고, modified Gompertz model은 기존에 존재하던 Gompertz model이 지니고 있던 균 수의 S자형 성장 표현의 부족함을 보완하여 수정된 함수이다(McKellar and Lu, 2003; Van Impe et al., 2005). 본 연구에서는 Baranyi model과 modified Gompertz model을 이용한 미생물 성장 예측 그래프를 그리고(Fig. 1&2), 각각의 예측 모델의 매개변수인 초기 미생물 값(y0), 최대 미생물 값(ymax), 최대 성장률(µmax), 유도기(γ)의 값을 계산하여 Table 3에 나타냈다.
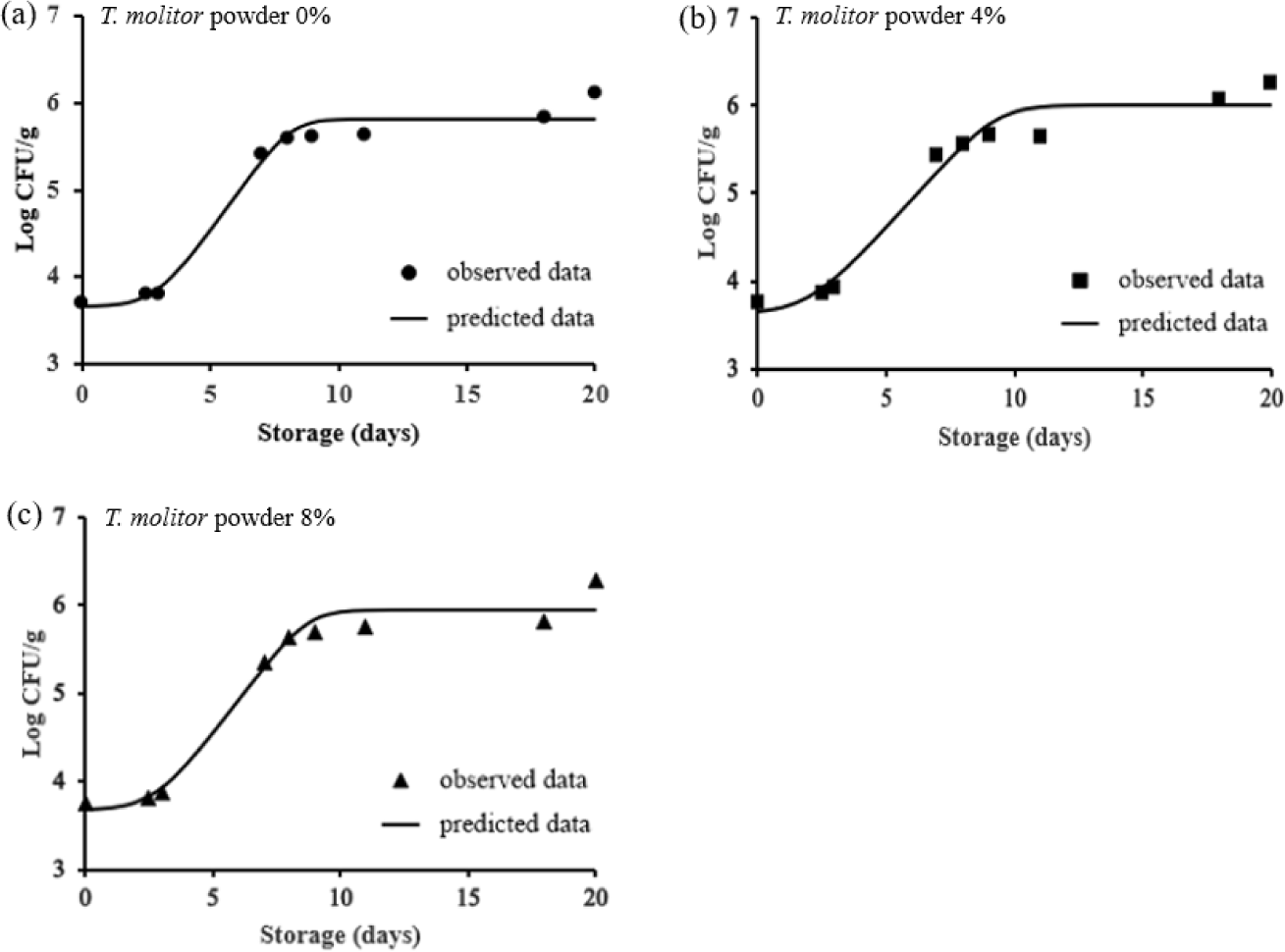
T. molitor powder 대체 햄버거 패티의 총 호기성 미생물 수를 Baranyi model에 기초하여 예측한 그래프를 Fig. 1의 (a)∼(c)에 나타냈다. 그래프에는 예측모델 검증을 위한 미생물 실험 데이터 지점(n=9) 또한 나타냈다. 유도기는 미생물이 새로운 환경에 적응하기 위해 일정 시간이 소요되는 조정 기간, 즉 성장을 시작하기 전의 정지 상태를 유지하는 시간으로 환경 변화에 대한 반응 지연시간을 의미한다(Swinnen et al., 2004). Baranyi model 적용 시 T. molitor powder 0(control), 4, 8%로 대체한 패티의 총 호기성 세균에 대한 유도기는 각각 2.87, 2.06, 2.76일이다(Table 3). 이는 T. molitor powder 4% 대체군에서 유도기가 가장 짧아 미생물이 환경 변화에 빠르게 적응함을 시사한다. T. molitor powder를 0, 4, 8% 대체한 패티 모두 유도기가 지난 후, 저장 3일차부터 20일차까지 각각 5.81, 6.01, 5.94 log CFU/g의 최대 미생물 값에 도달하였다. 예측 곡선의 가장 가파른 기울기를 의미하는 최대 성장률의 경우, T. molitor powder를 0, 4, 8% 대체한 패티 각각 0.41, 0.32, 0.38 log CFU/g/day로 T. molitor powder가 함유되지 않은 패티의 미생물 최대 성장률이 가장 높은 값을 나타냈다.
Fig. 2의 (a)∼(c)는 T. molitor powder로 대체된 햄버거 패티에서 총 호기성 세균 수를 modified Gompertz model를 기반으로 예측한 그래프와, 실제 실험에서 관찰된 검증 데이터(n=9)를 보여준다. T. molitor powder를 0, 4, 8% 대체한 패티의 유도기는 각각 2.91, 2.36, 2.85일로서, T. molitor powder 4% 대체군에서 가장 짧은 값을 보였다(Table 3). 유도기가 지난 후 약 17일간 더 저장하였을 때, 최대 미생물 값은 5.89, 6.02, 6.00 log CFU/g까지 성장했음을 알 수 있다. 또한 최대성장률은 T. molitor powder를 0(control), 4, 8% 대체한 패티 순서대로 0.44, 0.35, 0.41 log CFU/g/day로 확인되었다.
본 연구 결과, 모든 햄버거 패티 처리군에서 Baranyi model의 성장 매개변수들 보다 modified Gompertz model의 성장 매개변수들보다 더 높은 값을 나타냈다. 이는 모델 간의 함수 차이가 각 성장 매개변수들의 해석에 영향을 미칠 수 있음을 시사한다. 일반적으로 Baranyi model은 미생물 성장 초기의 유도기를 강조하며, 유도기가 미생물 성장에 미치는 영향을 보다 세밀하게 분석할 수 있다(Buchanan et al., 1997). 반면 Modified Gompertz model은 균의 부드러운 S자 형태의 성장을 설명하는데 적합하며, 저장 후반부의 성장률을 보다 정확히 반영할 수 있다고 보고된다(Buchanan et al., 1997). 적절한 미생물 예측 1차 모델의 선택은 다음 단계로 나아가기 위한 중요한 기초 단계이다(Fakruddin et al., 2012). 따라서 이후에는 통계적 지표를 활용하여 T. molitor powder로 대체한 패티의 Baranyi model과 modified Gompertz model의 비교 및 검증을 진행하여 Table 4에 나타냈다.
Baranyi model과 modified Gompertz model의 적합한 정도를 판단하기 위해 결정 계수(R2), 평균 제곱근 오차(RMSE), bias factors(Bf), accuracy factors(Af)들을 사용하여 2가지 유형의 모델의 적합도 및 통계적 특성을 비교했다(Table 4). R2값은 0과 1 사이의 분수로 모델의 적합도를 정량화 하는데 유용한 도구로 간주되며, 값이 0.9와 1에 위치할수록 특정 모델이 데이터를 잘 설명하고 있다는 것을 의미한다(Asuero et al., 2006). 따라서 저장기간에 따른 T. molitor powder 0(control), 4, 8%로 대체된 햄버거 패티의 두 가지 예측 미생물 모델 모두 적합한 통계적 데이터를 제공한다. 하지만 R2값은 모델이 데이터의 분산을 얼마나 잘 설명하는지를 제공하지만 모델의 전반적인 예측 성능과 신뢰성을 평가하기 위하여 다양한 통계적 지표를 종합적으로 고려해야 한다(Barrett, 1974).
Baranyi 등(1999)은 RMSE는 예측 미생물 모델에서 예측의 오차 정도를 나타내는 지표로, 예측 값과 관측 값의 차이를 제곱하여 평균에 루트를 씌운 값이며, 낮을수록 오차가 적다고 말하고 있다. T. molitor powder로 0, 4, 8% 대체한 패티의 총 호기성 세균에 대한 Baranyi model의 RMSE는 0.181, 0.342, 0.321로 확인되었으며, modified Gompertz model에서는 0.176, 0.319, 0.331이다. Control과 T. molitor powder로 4% 대체한 햄버거 패티 예측모델의 예측 오차 정도는 modified Gompertz model이 Baranyi model에 비교하여 더 낮게 나타났다. 또한 두 예측 모델 모두 T. molitor powder를 대체한 패티보다 control의 RMSE가 낮다는 것을 알 수 있었다. 절대 오차를 평가하기 때문에 오차가 클수록 RMSE가 커질 수 있지만 이상치에 민감하기 때문에 이로 인해 모델의 성능이 과소평가될 수 있다(Mentaschi et al., 2013).
Ross(1996)는 모델의 검증을 위한 또 다른 지표로 Bf와 Af를 제시했고, Bf는 모델이 예측하는 값의 편향을 나타내는 지표이며, Af는 모델의 정확도를 평가하는 지표라고 설명하고 있다. 또한 Ross(1999)의 다른 연구에는 균의 성장을 예측하는 모델에서 Bf가 0.9∼1.05에 있으면 좋은 모델, 0.7∼0.9 또는 1.06∼1.15에 있으면 받아들여질 수 있는 모델이고, 이외의 값에 위치하면 받아들여 질 수 없는 모델이라고 밝혀냈다. 이에 따르면 T. molitor powder 4% 대체군에 대한 Baranyi model을 제외하면 좋은 모델이고, T. molitor powder 4% 대체군의 Baranyi model 또한 받아들여질 수 있는 모델이다. 완벽한 예측 모델이 나타내는 Bf와 Af는 1이고 성능이 더 좋은 모델일수록 값이 1에 가깝지만, 일반적인 미생물 예측 모델은 변수로 인하여 값이 증가하거나 감소할 수 있다(Ross et al., 2000).
종합적으로, control에 대한 두 예측 모델의 RMSE를 비교하였을 때는 modified Gompertz model이 더 좋다고 평가될 수 있지만, Bf와 Af를 비교해 보았을 때 각각 0.994, 1.027로 Baranyi model의 전반적인 예측의 편향성과 정확성 부분에서 우수하게 나타났다. 또한 T. molitor powder 8%로 대체한 패티에 대한 두 예측 모델을 비교하였을 때 Baranyi model의 검증 지표인 RMSE, Bf, Af의 값이 각각 0.321, 1.048, 1.010으로 모든 지표가 modified Gompertz model보다 Baranyi model이 T. molitor powder 8%로 대체한 햄버거 패티의 냉장 저장하였을 때 총 호기성 세균에 대한 성장 예측을 더 정확하게 하였음을 시사한다. 하지만 T. molitor powder 4% 대체군의 예측 모델을 비교한 결과, modified Gompertz model의 RMSE, Bf, Af가 각각 0.319, 1.008, 1.100으로 나타나 Baranyi model보다 더 우수한 예측 성능을 보였다. 이는 modified Gompertz model이 T. molitor powder 4% 대체군을 냉장 저장했을 때 총 호기성 세균 성장 예측에서 더 정확하다는 것을 의미한다.
IV. 요 약
본 연구에서는 갈색거저리 유충 분말(0, 4, 8%)로 일부 돈육을 대체한 햄버거 패티의 미생물학적 안전성을 확인하기 위하여, 저장기간에 따른 총 호기성 세균 수와 대장균 수를 측정하였다. 이후 Baranyi model과 modified Gompertz model을 적용하여 미생물 예측모델을 개발하고 비교 및 검증하였다. 갈색거저리 유충 분말(0, 4, 8%)로 대체된 햄버거 패티를 20일간 4±1°C에서 저장하였을 때, 모든 패티에서 대장균은 관찰되지 않았다. 저장 0일차, 모든 햄버거 패티의 총 호기성 세균 수는 3.71∼3.76 log CFU/g으로 유사한 수준을 보였으며, 약 3일의 유도기가 지난 후 모두 유의적으로 증가하였다. 이후 관측된 값을 기초로 하여 Baranyi model과 modified Gompertz model의 매개변수들을 활용한 미생물 예측 모델을 개발하고 검증을 통한 두 모델을 비교하였다. 그 결과, 대조군(0%)과 갈색거저리 유충 분말 8% 대체군은 Baranyi model의 bias factor와 accuracy factor가 modified Gompertz model보다 우수한 값을 보여, 예측 모델 개발에 있어서 Baranyi model을 선택하는 것이 적절하다는 결과를 보였다. 반면, 갈색거저리 유충 분말 4% 대체군에서는 모든 통계적 지표가 modified Gompertz model에서 우수하여, 예측모델 개발 시 해당 모델을 사용하는 것이 타당하다는 결론에 이르렀다. 본 연구에서 개발된 미생물 예측 모델은 갈색거저리 유충 분말의 대체량에 따른 햄버거 패티의 최적 미생물 예측 모델 구축을 위한 기초 자료로 활용할 수 있을 것으로 사료된다. 하지만, 본 연구 결과, 갈색거저리 유충 분말 첨가량 수준에 따라 더 적절한 미생물 예측 모델을 선택하는데 있어서 차이가 발생하였다. 추후 연구에서는 이러한 원인이 어떤 것들이 있는지 알아보기 위해 2차 미생물 예측 모델을 개발하고 검증할 필요가 있다. 정확한 예측 모델의 개발은 육가공품의 품질 관리 시스템에 적용, 미생물학적 안전성을 향상시키고, 소비자의 신뢰 확보, 나아가 국가와 사업체 등의 미생물로 발생할 수 있는 경제적•사회적 손실에 대한 보장이 가능하다. 추후 갈색거저리 유충 분말로 대체된 햄버거 패티의 정확한 예측 모델 개발뿐만 아니라, 저장기간에 따른 품질, 관능적 특성(맛, 향, 질감 등) 및 소비자 선호도 조사를 병행하여 식용곤충 시장 확대를 위한 연구를 지속할 필요성이 있다.






